
期刊简介
《山西医药杂志》是山西省创刊最早的综合医学期刊,有近四十年的历史,具有载文量大、信息面广、内容丰富、印刷质量上乘的特点,是全国中文核心期刊之一,在省内多次被评为优秀期刊和一级期刊。《山西医药杂志》的前身为《山西医学杂志》,创刊于1957年6月,由中华医学会山西分会主办,山西医学杂志社出版发行。该刊为综合性医学期刊,16开,64页,全国公开发行。总编邵象伊,副总编3人,常务编辑4人。1966年9月《山西医学杂志》停刊,10年间,编辑出版10卷38期。1972年,恢复《山西医学杂志》并更名为《山西医药》,以内部期刊赠送全省各级医疗卫生单位。1974年2月,《山西医药》更名为《山西医药杂志》,继续以内部刊物向全省各地发送。1976年10,《山西医药杂志》(双月刊)向全国公开发行,发行量达到1万多册。1984年《山西医药杂志》从山西卫生报刊编辑部独立,定编5人/1985年,该刊增设胶印插页,主要文章附中、英文摘要,质量明星提高。1989年《山西医药杂志》被评为山廿省优秀科技期刊,同日本东洋医学社建立互换关系,发行量每期突破2万册,居国内省级医学期刊之首。《山西医药杂志》现为双月刊,大16开,88页,期定价为3.50元,双月15日出版,国内外公开发行,国际标准刊号 ISSN 0253-9926 中国标准刊号CN14-1108/R 邮发代号22-38 编辑部地址:山西省太原市华门23号 邮编030013。本刊由中华医学会山西分会主办,山西省卫生厅主管,现任社长兼总编:董海原,主要读者对象为各级医疗卫生技术人员和医学院校师生。多年年,《山西医药杂志》在“党的路线方针政策指引下,坚持普及与提高相结合,侧重普及;坚持理论与实用相结合,注重实用;坚持百花齐放,百家争鸣,立足山西,面向全国,为山西能源重化工基地建设股务,为全国股务”的办宗旨引导下,为宣传和政府的科技方针政策,传递医学信息,开展学术交流,促进医学科技成果转化为生产力做出了一定的贡献。《山西医药杂志》1992年9月被《中文核心期刊要目总览》列为综合性医药、卫生类核心期刊(第32位);1989年被评为山西省优秀期刊;1990年获优秀期刊提名奖;1992、1993年被评为山西省一级期刊;1995-2002年连续被评为山西省一级期刊;1998年被共青力省委、山西省卫生厅授予“青年文明号”称号;1999年获山西省第二届书刊装帧艺术作品三等奖。2002年获国家级“青年文明号”。
靶向CD7的“现货型”CAR-T细胞疗法在复发/难治性T细胞恶性肿瘤中的疗效
时间:2023-11-21 09:58:42
T细胞急性淋巴细胞白血病(T-ALL)是一种高度侵袭性的血液系统恶性肿瘤,其占成人ALL病例的25%,占儿童ALL的15%。与B-ALL相似,T-ALL成人患者也存在治愈可能,其5年总生存(OS)率为48%。然而,复发/难治性(R/R)T-ALL成人患者的预后结局较差,其长期生存率低于10%。这些患者需要包括靶向药物和嵌合抗原受体T细胞(CAR-T)疗法在内的新型疗法来改善远期生存。
跨膜蛋白CD7在95%的T-ALL患者中高表达,因此其为T-ALL治疗的理想靶点。GC027是一种靶向CD7的“现货型”同种异体CAR-T产品,研究者先前开展了一项初步临床试验,数据表明GC027在R/R T-ALL患者中产生了快速、深入和持久的缓解。基于此,陆军军医大学第二附属医院(新桥医院)张曦教授、中国人民解放军联勤保障部队第九二O医院王三斌教授团队扩大了研究队列,报告了GC027作为独立治疗方案在R/R T-ALL成人患者的扩大患者组中的最新疗效结果。
研究方法
该试验为多中心I期临床试验(ChiCTR1900025311)。试验的关键纳入标准包括年龄为18-70岁,确诊为R/R T-ALL,入组时流式细胞术或免疫组化检测确定具有CD7+白血病原始细胞。通过骨髓活检,纳入的患者在形态学上确诊为T-ALL,且ECOG体能状态评分为0-2。伴有活动性感染或主要器官功能障碍的患者被排除在外。该临床试验的主要目的是评估GC027的安全性,次要目的是评估其药代动力学特征和疗效。主要终点是4周内的剂量限制毒性(DLT)和3个月内的不良事件(AE);次要终点是GC027输注后3个月内的总缓解率(ORR),外周血和骨髓中CAR-T细胞数和CAR拷贝数。该试验计划患者接受>4×106 CAR+T细胞/kg。鉴于GC027与患者自身CD3+CD7-细胞排斥的特点,研究者设置了两个剂量阶段:低剂量阶段和剂量扩展阶段。低剂量阶段的剂量为6×106 CAR+T细胞/kg,计划入组3例患者,剂量扩展阶段包含两个剂量组:1×107 CAR+T细胞/kg和1.5×107 CAR+T细胞/kg。
研究结果
01患者临床特征
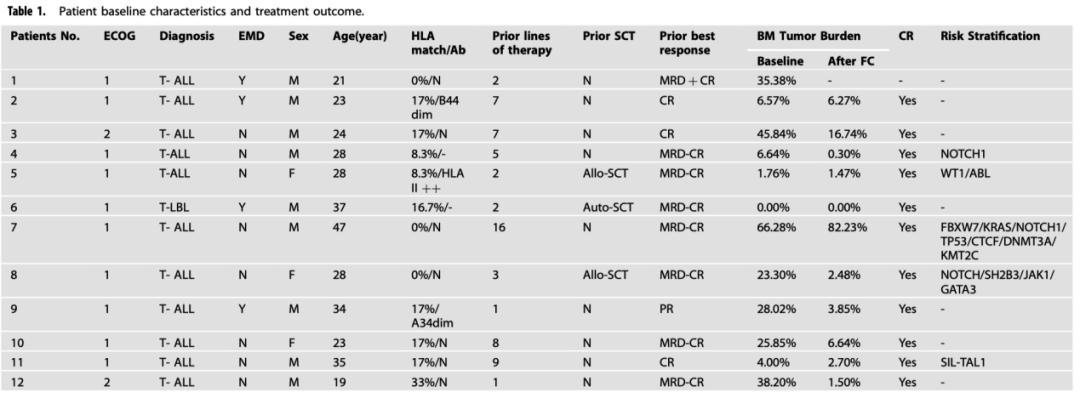
该临床试验最终纳入了12例患者,其中11例为R/R T-ALL,1例为R/R T淋巴母细胞淋巴瘤(T-LBL)。所有患者(n=12)的中位年龄为28(19-47)岁。依据流式细胞术检测,骨髓肿瘤负荷的中位值为24.5%(0-66.28%)。入组时,4例患者伴有髓外疾病,3例在异基因造血干细胞移植(allo-HSCT)后复发。3例患者接受了6.2–8.6×106 CAR+T细胞/kg,9例接受了1–1.5×107细胞/kg。在输注CAR-T细胞前,所有患者均接受了4-6天的清淋预处理方案。清淋预处理方案的化疗药物包括剂量增强的氟达拉滨+环磷酰胺,联合美法仑/依托泊苷/泼尼松。具体临床特征见表1。
表1.所有患者的临床基线特征及疗效结果
02疗效及安全性结果
在所有患者(n=12)中,11例患者在CAR-T细胞输注后1个月内达到完全缓解(CR)或伴血液学不完全恢复的CR,CR率为91.7%;在所有患者中,CAR-T细胞从输注后迅速扩增,并在输注后5-10天达到峰值。在4例伴有髓外疾病的患者中,3例达到CR。在达到CR的患者(n=11)中,1例接受了allo-HSCT,其余10例在缓解后均未接受其他抗白血病治疗。8号患者(P08)在GC027输注后达到CR,接受allo-HSCT以降低复发风险,移植后1个月因严重GVHD死亡;P10因严重感染死亡。4例患者在5-10个月内复发。数据截止于2022年11月30日,2例患者仍处于缓解期,P03缓解时间大于3年。
该试验中,研究者未观察到免疫效应细胞相关神经毒性综合征(ICANS)的发生。10例(83%)患者出现了任何级别的细胞因子释放综合征(CRS),其中2例为2级,8例为3级。CRS发生于CAR-T细胞输注当天或第二天。及时治疗后,8例3级CRS患者均缓解。Fisher精确检验结果表明,CAR-T输注剂量与CRS等级之间没有显著的相关性(相关性=0,p=1.00)。疗效和安全性结果见图1。
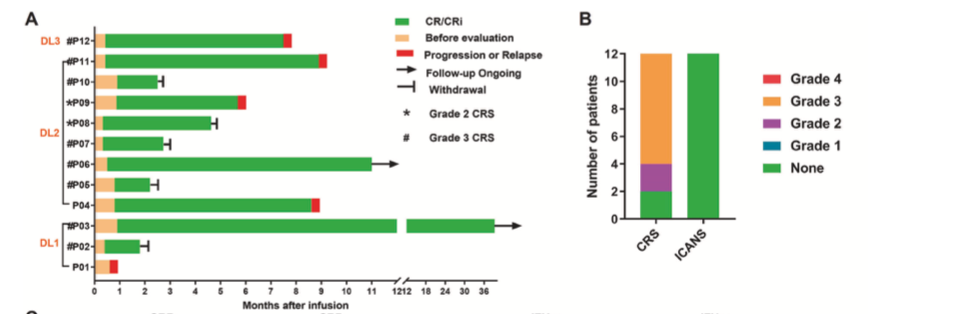
图1.所有患者CAR-T输注后的生存情况(A);CRS和ICANS的结果(B)
研究结论
该研究表明,同种异体“现货型”CAR-T细胞疗法GC027作为一种独立疗法,在接受重度预处理的T细胞恶性肿瘤患者中显示出良好的早期疗效。单次输注GC027能够在输注后4周内诱导深度和持久的缓解,且临床毒性可控。为取得更好的临床疗效,应考虑加强对感染患者的护理,并桥接allo-HSCT。
